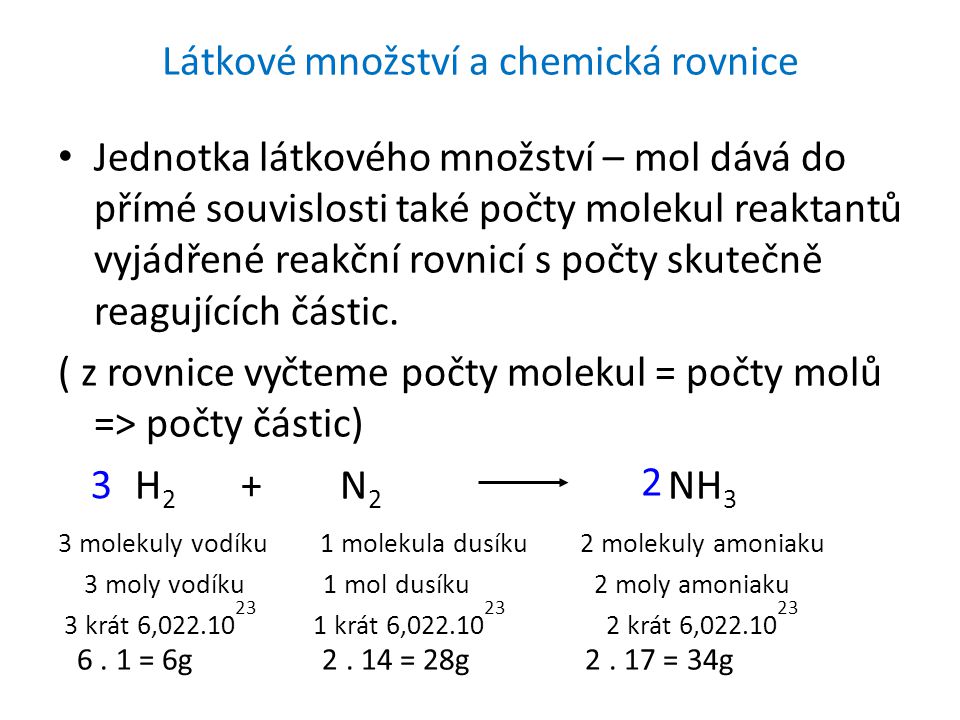
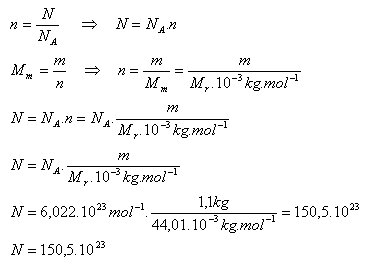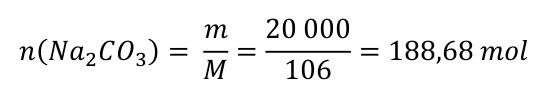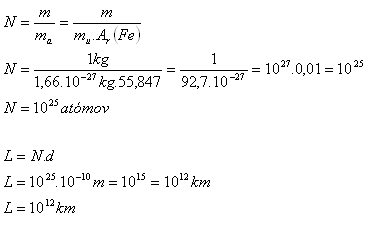m=ρ.v M=m/n n=m/m m=n.m M(Cu)=63,5g/mol M(S)=32,1g/mol M(O)=16,0g/mol M(CuSO 4 )=1. M(Cu)+1. M(S)+4. M(O)= =63,5+32,1+4.16,0=63,5+32,1+64=159,6g/mol - PDF Free Download

m=ρ.v M=m/n n=m/m m=n.m M(Cu)=63,5g/mol M(S)=32,1g/mol M(O)=16,0g/mol M(CuSO 4 )=1. M(Cu)+1. M(S)+4. M(O)= =63,5+32,1+4.16,0=63,5+32,1+64=159,6g/mol - PDF Free Download

LÁTKOVÉ MNOŽSTVÍ Vypočítejte látkové množství oxidu uhelnatého, ve kterém je 9, molekul tohoto plynu. Řešení: - pro výpočet použijeme vztah n. - ppt stáhnout

CHEMICKÉ VÝPOČTY MOLÁRNÍ HMOTNOST LÁTKOVÉ MNOŽSTVÍ PROJEKT EU PENÍZE ŠKOLÁM OPERAČNÍ PROGRAM VZDĚLÁVÁNÍ PRO KONKURENCESCHOPNOST - PDF Free Download